Actualizado a: 22 de enero de 2024
La batería de litio es uno de los grandes inventos de los últimos tiempos, ya que su capacidad y densidad han permitido que multitud de aparatos diferentes se puedan beneficiar de ellas, desde portátiles, hasta dispositivos móviles, pasando por otros equipos electrónicos muy variados. Pero… ¿realmente sabes cómo funciona?
También te interesará conocer:
¿Qué es una batería?

Una pila o batería es un dispositivo electroquímico que almacena energía química y la convierte en energía eléctrica mediante una reacción química controlada. Consiste en una o varias celdas electroquímicas conectadas en serie o en paralelo para proporcionar la tensión y la capacidad deseadas.
Una pila o batería consta de tres componentes principales:
- Cátodo (+): es el electrodo positivo de la pila donde ocurre la reducción de los iones durante la reacción electroquímica.
- Ánodo (-): es el electrodo negativo de la pila donde ocurre la oxidación de los iones durante la reacción electroquímica.
- Electrolito: es un medio conductor, líquido o sólido, que permite el flujo de iones entre el cátodo y el ánodo durante la reacción química.
Cuando la pila está en uso, los componentes químicos en el ánodo y el cátodo reaccionan entre sí, liberando electrones que fluyen a través de un circuito externo, generando así electricidad. Esta reacción química continúa hasta que se agoten los materiales activos en los electrodos, momento en el cual la pila ya no puede suministrar energía y se agota.
Un poco de historia
La historia de la batería o pila se remonta a varios siglos atrás. Aquí tienes un resumen de los principales hitos en el desarrollo de la batería a lo largo del tiempo.
Uno de los primeros descubrimientos que sirvieron de base para la batería fue el de la electricidad estática. En el siglo VI a.C., los antiguos griegos observaron la electricidad estática al frotar ámbar con piel de animal. Sin embargo, en ese momento, no se comprendía completamente el fenómeno.
Alessandro Volta, en 1800, científico italiano, desarrolló la primera batería química conocida como la «pila voltaica». Consistía en discos alternados de zinc y cobre separados por trozos de cartón empapados en una solución salina. Esta invención fue fundamental para el desarrollo posterior de la electricidad y estableció los fundamentos de las baterías modernas.
En 1836, el químico británico John Frederic Daniell inventó la batería de Daniell, que mejoró el diseño de la pila voltaica. Utilizaba un electrolito de sulfato de cobre y una combinación de zinc y cobre para generar una corriente constante y estable durante un período más largo.
Unas décadas más tarde, el francés Gaston Planté desarrolló la batería de plomo-ácido, que es la base de las baterías de automóviles modernas. Utiliza una solución de ácido sulfúrico y placas de plomo sumergidas en la solución para generar electricidad. Estas baterías son recargables y han sido ampliamente utilizadas en diversas aplicaciones.
A finales del siglo XIX y principios del XX, se desarrollaron las baterías secas, que utilizaban un electrolito en forma de pasta en lugar de una solución líquida. Posteriormente, en la década de 1950, se introdujeron las baterías alcalinas, que utilizan una combinación de hidróxido de potasio y zinc como electrolito, y ofrecen una mayor capacidad y vida útil en comparación con las baterías secas convencionales.
En las décadas de 1980 y 1990, se introdujeron las baterías recargables de níquel-cadmio y níquel-metal hidruro. Estas baterías han sido ampliamente utilizadas en dispositivos electrónicos portátiles y aplicaciones industriales debido a su capacidad de recarga y mayor densidad de energía en comparación con las baterías de plomo-ácido.
A partir de la década de 1990, las baterías de iones de litio se han vuelto dominantes en muchas aplicaciones electrónicas. Son recargables, tienen una alta densidad de energía y se utilizan en dispositivos como teléfonos móviles, computadoras portátiles, vehículos eléctricos y sistemas de almacenamiento de energía.
A lo largo de la historia, la evolución de las baterías ha sido impulsada por la necesidad de almacenar y suministrar energía de manera más eficiente y sin necesidad de cables o tomas de corriente cercanas. Los avances en tecnología de baterías continúan hasta el día de hoy, impulsados por la demanda de soluciones más sostenibles y eficientes energéticamente, además de mejorar la densidad de carga, otro de los grandes retos…
Tipos de batería

Las pilas o baterías se pueden catalogar de varias formas. Una de ellas es según sean primarias o secundarias:
- Baterías primarias (no recargables o desechables): son diseñadas para un solo uso. No se pueden recargar una vez que se agotan. Estas baterías son selladas y contienen todos los materiales químicos necesarios para producir una reacción electroquímica y generar energía eléctrica. Algunos ejemplos comunes de baterías primarias son las pilas alcalinas, las pilas de botón y las pilas de litio.
- Baterías secundarias (recargables o reutilizables): son diseñadas para ser recargadas y utilizadas múltiples veces. Después de agotarse, se pueden recargar conectándolas a una fuente de energía externa, como un cargador. Estas baterías contienen componentes químicos que pueden experimentar una reacción reversible, lo que permite que la batería se recupere y se vuelva a cargar. Algunos ejemplos comunes de baterías secundarias son las baterías de iones de litio, las baterías de níquel-metal hidruro y las baterías de plomo-ácido.
Existen varios tipos de baterías según la composición, como algunas populares tipo:
- Baterías de plomo-ácido: son ampliamente utilizadas en vehículos, sistemas de respaldo de energía y aplicaciones industriales. Son económicas y ofrecen una alta capacidad de corriente, pero son pesadas y tienen una vida útil limitada.
- Baterías de iones de litio (Li-ion): son ampliamente utilizadas en dispositivos electrónicos portátiles, como teléfonos móviles, computadoras portátiles y cámaras digitales. Son livianas, tienen una alta densidad de energía y no sufren el «efecto memoria». Son más costosas que las baterías de plomo-ácido, pero ofrecen una mayor vida útil.
- Baterías de polímero de litio (Li-Po): son similares a las baterías de iones de litio, pero utilizan un electrolito sólido o semisólido en lugar de líquido. Se usan en dispositivos más delgados y livianos, como teléfonos inteligentes, tabletas y dispositivos portátiles.
- Baterías de níquel-cadmio (NiCd): fueron populares en el pasado, pero su uso ha disminuido debido a su contenido de cadmio tóxico. Aún se utilizan en aplicaciones que requieren una alta tasa de descarga, como herramientas eléctricas.
- Baterías de níquel-metal hidruro (NiMH): son una alternativa más respetuosa con el medio ambiente a las baterías de níquel-cadmio. Se utilizan en dispositivos como cámaras digitales, juguetes y herramientas eléctricas.
- Baterías de hidrógeno y oxígeno (celdas de combustible): Generan electricidad a partir de la reacción química entre el hidrógeno y el oxígeno. Se utilizan en aplicaciones que requieren una gran cantidad de energía y largos períodos de funcionamiento, como vehículos eléctricos y sistemas de energía renovable.
Estos son solo algunos ejemplos de los diferentes tipos de baterías disponibles en la actualidad. Cada tipo de batería tiene características únicas en términos de capacidad, densidad de energía, vida útil, costos y aplicaciones específicas para las que son más adecuadas.
Tipos de baterías de litio

Los tipos de batería de litio más comunes son las baterías de iones de litio (Li-ion) y las baterías de polímero de litio (Li-Po). A continuación, se explica cada uno de ellos:
- Baterías de iones de litio (Li-ion): son ampliamente utilizadas en una variedad de dispositivos electrónicos portátiles, como teléfonos móviles, computadoras portátiles, cámaras digitales y dispositivos de audio. Estas baterías están compuestas por celdas individuales que contienen un electrolito líquido conductor de iones de litio.
- Ventajas:
- Alta densidad de energía: ofrecen una alta capacidad de almacenamiento de energía en comparación con otras tecnologías de batería.
- Baja tasa de autodescarga: pierden carga a un ritmo más lento cuando no están en uso, lo que permite un almacenamiento prolongado.
- Menor efecto memoria: no sufren tanto el llamado «efecto memoria», lo que significa que no es necesario descargar completamente la batería antes de recargarla.
- Vida útil prolongada: tienen una vida útil más larga en comparación con otras baterías recargables.
- Ventajas:
- Baterías de polímero de litio (Li-Po): también conocidas como baterías de iones de litio poliméricas, son una variante de las baterías de Li-ion. Utilizan un electrolito sólido o semisólido en lugar del electrolito líquido presente en las baterías de Li-ion tradicionales. Además, las celdas en una batería Li-Po suelen estar envueltas en un material flexible.
- Ventajas:
- Mayor flexibilidad de diseño: la forma y el tamaño de las baterías de Li-Po son más flexibles y adaptables a diferentes diseños de dispositivos, lo que permite una mayor variedad de formas y tamaños de batería.
- Mayor densidad de energía: las baterías Li-Po tienen una mayor densidad de energía en comparación con las baterías de Li-ion tradicionales, lo que las hace ideales para dispositivos más delgados y livianos.
- Menor riesgo de fuga: tienen menos riesgo de fugas de electrolito debido a su construcción sellada.
- Ventajas:
Es importante tener en cuenta que tanto las baterías de Li-ion como las de Li-Po requieren un manejo y uso adecuados para garantizar la seguridad. Las baterías de litio deben cargarse con cargadores específicos y no deben ser expuestas a condiciones extremas de temperatura o golpes fuertes, ya que pueden provocar daños o incluso un riesgo de incendio o explosión.
Ambas se pueden ver afectadas por el efecto memoria, aunque en menor medida que otras baterías más antiguas…
¿Cuáles son las partes de una batería de litio?
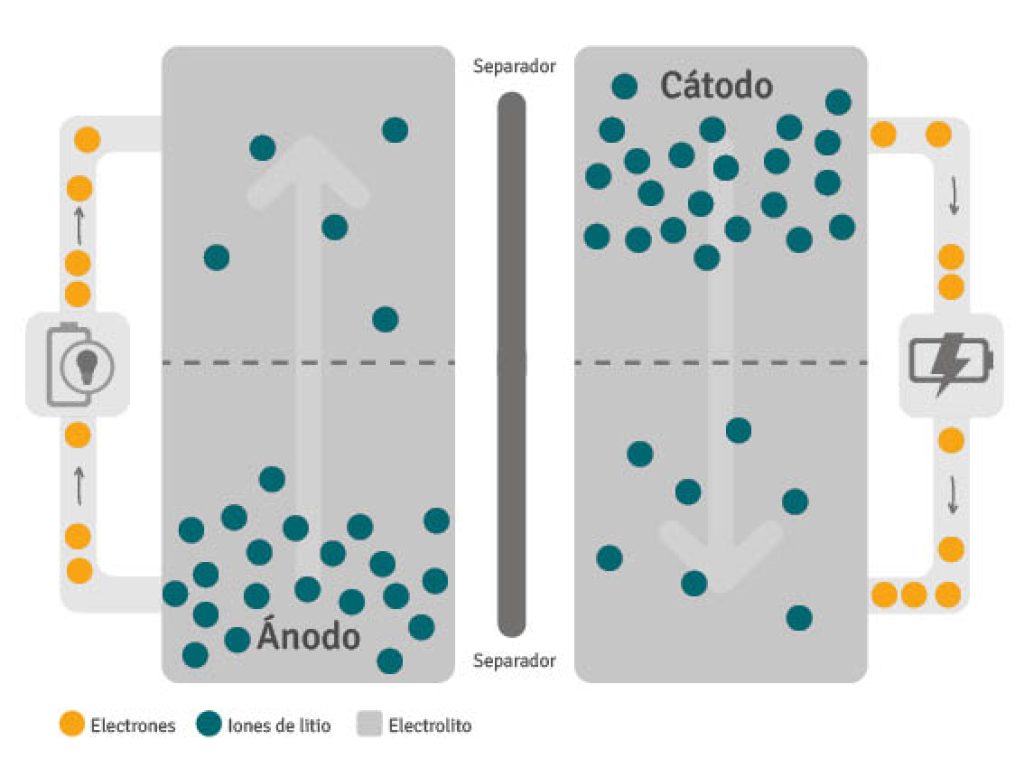
Antes ya cité las partes fundamentales de una batería en general, como el cátodo, el ánodo y el electrolito. Pero ahora vamos a ver eso mismo aplicado a las baterías de litio de forma específica:
- Cátodo (+): es el componente donde se encuentra el material activo de litio, generalmente en forma de óxido. Este material activo está recubierto en una lámina delgada de aluminio, que actúa como soporte estructural. También se añaden un aditivo conductor y un aglutinante. El material activo contiene iones de litio, el aditivo conductor mejora la conductividad, y el aglutinante asegura la correcta adhesión del material aluminio y el material activo. El cátodo es crucial para determinar las características de la batería, como su capacidad y voltaje, que son determinados por el tipo de material activo utilizado en el cátodo. Una mayor cantidad de litio en el cátodo se traduce en una mayor capacidad, mientras que una mayor diferencia de potencial entre el cátodo y el ánodo resulta en un voltaje más alto.
- Ánodo (-): también está recubierto con un material activo que permite el flujo de corriente eléctrica a través del circuito externo y la absorción/emisión reversible de iones de litio liberados por el cátodo. Durante la carga, los iones de litio se almacenan en el ánodo en lugar del cátodo. Cuando la batería se descarga, los iones de litio fluyen naturalmente desde el ánodo hacia el cátodo a través del electrolito, y los electrones separados de los iones de litio generan electricidad a lo largo del cable. Para el ánodo se utiliza grafito, un material estable, y se recubre con material activo, aditivo conductor y aglutinante. El grafito es adecuado para el ánodo debido a su estabilidad estructural, baja reactividad electroquímica, capacidad de almacenar iones de litio y costo.
- Electrolito: el electrolito es el conductor que permite la conexión entre el cátodo y el ánodo, permitiendo el flujo de electricidad en la batería. Actúa como un medio para el movimiento de iones de litio entre el cátodo y el ánodo. Se utilizan materiales con alta conductividad iónica para facilitar el desplazamiento de los iones de litio. El electrolito está compuesto principalmente por sales, disolventes y aditivos. Las sales permiten el movimiento de los iones de litio, los disolventes son líquidos orgánicos utilizados para disolver las sales, y los aditivos se añaden en pequeñas cantidades con propósitos específicos. El electrolito solo permite el paso de iones y no de electrones, y la velocidad de movimiento de los iones de litio depende del tipo de electrolito utilizado.
- Separador: mientras que el cátodo y el ánodo influyen en el rendimiento básico de la batería, el electrolito y el separador son cruciales para garantizar la seguridad. El separador actúa como una barrera física que mantiene separados el cátodo y el ánodo, evitando el flujo directo de electrones. Sin embargo, a través de sus poros, permite el paso de iones. Los separadores utilizados actualmente son resinas sintéticas, como el polietileno (PE) y el polipropileno (PP).
Como ves, en el caso de las baterías de litio, para entender el funcionamiento, también hay que conocer una parte adicional, como es el separador, ya que es clave en el funcionamiento de la batería.
Funcionamiento de la batería de litio
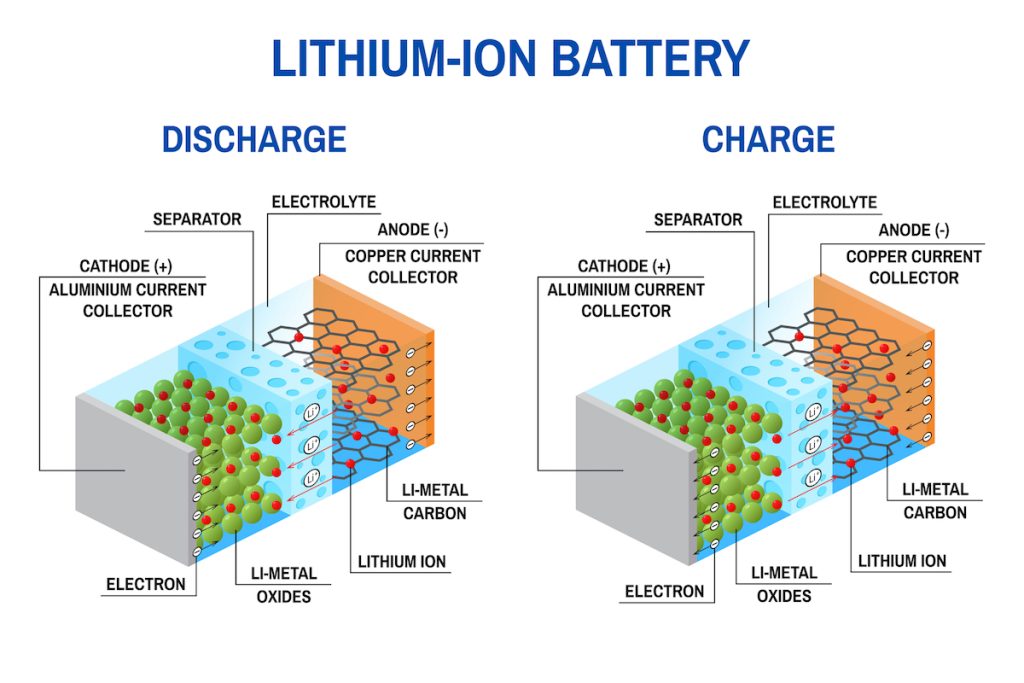
Ahora vamos a analizar los dos ciclos de la batería de litio para ver realmente cómo funciona:
Ciclo de descarga
Aquí te explico paso a paso cómo funciona una batería de litio durante un ciclo de descarga:
- Estado inicial: antes de iniciar el ciclo de descarga, la batería de litio está completamente cargada y lista para suministrar energía eléctrica. Los bornes o contactos de ésta, es decir, el ánodo y cátodo, no están en contacto con nada o hay algún tipo de interrupción en el circuito en el que están conectados. De este modo, se evita la descarga.
- Activación: una vez se conecta un circuito externo, o se deja de interrumpir el circuito conectado, los terminales de la batería comienzan a dejar salir corriente para que fluya a través del circuito. La corriente eléctrica no es más que un flujo de electrones. Es decir, los electrones liberados en el ánodo (terminal negativo) comienzan a fluir hacia el cátodo (terminal positivo) a través del circuito externo. Esto es lo que hace que el circuito conectado pueda funcionar. Pero, para que esos electrones fluyan, es necesario crearlos. A medida que los electrones abandonan el ánodo, los iones de litio presentes en el ánodo se liberan y se desplazan hacia el cátodo a través del electrolito. Esta emisión de iones de litio permite mantener el equilibrio de carga en la batería durante el ciclo de descarga. Los iones de litio se mueven a través del electrolito desde el ánodo hacia el cátodo, atravesando el separador que mantiene separados los dos electrodos. El electrolito facilita el movimiento de los iones de litio al ser un medio conductor. A medida que los iones de litio llegan al cátodo, se produce una reacción electroquímica en el material activo del cátodo, que generalmente es un compuesto de litio. Durante esta reacción, los iones de litio se incorporan al material activo del cátodo, liberando electrones en el proceso. Los electrones liberados en el cátodo se combinan con los iones de litio y los iones del electrolito en el cátodo, lo que permite que la batería suministre energía eléctrica al dispositivo conectado.
- Disminución de la capacidad: a medida que la descarga continúa, los iones de litio se consumen en el cátodo, reduciendo la cantidad disponible para la reacción electroquímica. Con el tiempo, la capacidad de la batería disminuirá y la tensión de salida también se reducirá gradualmente. El ciclo de descarga se considera completo cuando la capacidad de la batería alcanza un nivel bajo o cuando la tensión de salida alcanza un valor mínimo aceptable para el dispositivo. En este punto, la batería se considera agotada y es necesario recargarla para su uso posterior, es decir, revertir este proceso electroquímico para que vuelva a tener disponibilidad.
Ciclo de carga
Para recargar la batería, se necesita el ciclo de carga, en el que se dan los siguientes pasos:
- Estado inicial: antes de iniciar el ciclo de carga, la batería de litio se encuentra en un estado descargado o parcialmente descargado, con una capacidad reducida para suministrar energía eléctrica.
- Conexión del cargador: se conecta un cargador adecuado a los terminales de la batería para iniciar el proceso de carga. El cargador suministra una corriente eléctrica al sistema de la batería. Es decir, se gasta energía eléctrica para poder llenar la batería nuevamente de capacidad. La corriente eléctrica proveniente del cargador fluye a través del cátodo (terminal positivo) hacia el ánodo (terminal negativo) de la batería. A medida que fluye la corriente, ocurre una reacción electroquímica en el cátodo de la batería. Durante esta reacción, los iones de litio liberados durante el ciclo de descarga anterior regresan al material activo del cátodo, junto con los electrones provenientes del circuito externo. Los iones de litio se desplazan desde el cátodo hacia el ánodo a través del electrolito. Durante este proceso, el electrolito actúa como un medio conductor que permite el movimiento de los iones de litio. En el ánodo, los iones de litio son absorbidos por el material activo del ánodo, que suele ser grafito. Esta absorción permite almacenar los iones de litio en el ánodo mientras se produce la carga. A medida que los iones de litio son absorbidos en el ánodo, se almacena energía potencial en la estructura de la batería. Esta energía almacenada se utilizará posteriormente durante el ciclo de descarga para suministrar energía eléctrica al dispositivo conectado.
- Aumento de la capacidad: con el tiempo, a medida que la carga continúa, la cantidad de iones de litio almacenados en el ánodo aumenta, lo que aumenta la capacidad de la batería para suministrar energía.
- Fin del ciclo de carga: el ciclo de carga se considera completo cuando la batería alcanza su capacidad máxima o cuando se alcanza un nivel de carga suficiente para el uso deseado. En este punto, se detiene el flujo de corriente del cargador y la batería se considera completamente cargada.
Ahora podría empezar el ciclo de descarga nuevamente…





Excelente nota, muy clara la explicación. Muchas gracias